Resumen
El recuento plaquetario elevado es un signo de una variedad de trastornos que pueden conllevar a cuadros graves o significar enfermedades subyacentes, como el cáncer o enfermedades inflamatorias. Por ello es importante determinar la etiología de la trombocitosis para evaluar el riesgo e indicar el tratamiento adecuado.
Objetivo. Investigar las causas asociadas a la trombocitosis mediante una revisión sistemática de la literatura.
Método. De acuerdo a las pautas de PRISMA se realizó una revisión sistemática. La búsqueda utilizó la base de datos de PubMed, SCOPUS y Springer. La búsqueda incluyó palabras clave y los operadores booleanos AND y OR. Se consideraron estudios y artículos de revisión en idioma español e inglés publicados entre 2019 y 2023.
Resultados. Se analizaron 17 artículos recientes de un total de 1634, demostrando una etiología diversa y compleja de la trombocitosis. Dentro de la etiología destacan condiciones primarias, como la mutación MPL y JAK2V617F+ET[G1] , edad prematura También están las causas secundarias como el infarto esplénico, EPOC, espondiloartritis, anemia ferropénica, los procesos neoplásicos como el cáncer colorrectal, cáncer de pulmón, cáncer epitelial de ovario, entre otros. Enfermedades que desarrollaron trombocitosis en la edad pediátrica fueron el COVID-19, epilepsia e infecciones por Clostridium perfringens.
Conclusión. Si bien es cierto que las enfermedades y condiciones que conllevan a la trombocitosis son múltiples, todas tienen mecanismos similares que pueden ser explicados con la etiología primaria. Este análisis resalta la importancia de considerar el recuento plaquetario como indicador en el diagnóstico y terapia.
Abstract
High platelet count leads to a variety of disorders that can lead to serious conditions or signify underlying diseases such as cancer or inflammatory diseases. Therefore, it is important to determine the etiology of thrombocytosis to evaluate the risk and provide appropriate treatment.
Objective. To investigate the causes associated with thrombocytosis through a systematic review of the literature.
Method. According to PRISMA guidelines, a systematic review was carried out. The search used the PubMed, SCOPUS and Springer databases. The search included keywords and boolean AND and OR connections. Studies and review articles in Spanish and English published between 2019 and 2023 were considered.
Results. 17 recent articles out of a total of 1634 were analyzed, demonstrating a diverse and complex etiology of thrombocytosis. Within the etiology, primary conditions stand out such as the MPL and JAK2V617F+ET[G2] mutation, premature age. There are also secondary causes such as splenic infarction, COPD, spondyloarthritis, iron deficiency anemia, neoplastic processes such as colorectal cancer, lung cancer, epithelial ovarian cancer, among others. Diseases that developed thrombocytosis in pediatric age were COVID-19, epilepsy and Clostridium perfringens infections.
Conclusion. Although it is true that the diseases and conditions that lead to thrombocytosis are multiple, they all have similar mechanisms that can be explained with the primary etiology. This analysis highlights the importance of considering platelet count as an indicator in diagnosis and therapy.
Introducción
La trombocitosis es una condición que ha recibido considerablemente menos atención y estudio en comparación con su contraparte, la trombocitopenia. A menudo pasa desapercibida y es menos comprendida en comparación con la disminución de plaquetas en la sangre, lo que resalta la necesidad de una mayor investigación y conciencia. La trombocitosis es una condición en la que el recuento de plaquetas en la sangre está por encima del límite superior. El valor de corte normal más comúnmente aceptado es de 450 x 103/μL, aunque este valor umbral varía ampliamente. Las principales complicaciones médicas de la trombocitosis son la hemorragia y los eventos trombóticos, pero a menudo ocurre sin síntomas(1-3). La trombocitosis se puede dividir en dos grupos principales: primaria y secundaria. La trombocitosis primaria se debe a una anomalía no regulada de la producción de plaquetas en las células progenitoras de la médula ósea. Por lo general, se asocia con el grupo de neoplasias mieloproliferativas. Las trombocitosis primarias, especialmente la trombocitemia esencial y la policitemia vera, tienen un mayor riesgo de trombosis y hemorragia en comparación con la trombocitosis secundaria (1,4-6).
La trombocitosis secundaria, también conocida como trombocitosis reactiva, se define como un recuento de plaquetas anormalmente alto debido a eventos subyacentes, enfermedades o el uso de ciertos medicamentos. La trombocitosis secundaria es el tipo más común, y generalmente se identifica en los resultados de laboratorio de rutina. Entre los pacientes con trombocitosis, se sabe que entre el 80 y el 90% tiene trombocitosis secundaria. Las causas reactivas de la trombocitosis incluyen procesos transitorios como pérdida aguda de sangre, infección aguda, deficiencia de hierro, asplenia, cáncer, enfermedades inflamatorias crónicas o infecciosas (3,7).
El objetivo de esta revisión sistemática es investigar las causas asociadas a la trombocitosis mediante una revisión sistemática de la literatura. Se centra en la trombocitosis primaria y secundaria, y explora las causas subyacentes de cada tipo. Esta revisión sistemática proporciona una visión general actualizada de la etiología de la trombocitosis. La información obtenida puede ayudar a los médicos a diagnosticar y tratar esta condición.
Metodología
Esta revisión sistemática incluyó artículos actualizados sobre patologías asociadas a la manifestación de trombocitosis. La estrategia de búsqueda, bases de datos consultadas y criterios de selección se muestran a continuación:
A. Estrategia de búsqueda
Se realizó una búsqueda para identificar literatura que describa patologías que pueden causar un aumento del número de plaquetas, llegando hasta niveles categorizados como trombocitosis. Además, se establecieron límites de tiempo e idioma. Se vincularon adecuadamente las palabras clave mediante operadores booleanos para maximizar la relevancia de los resultados obtenidos ("thrombocytosis" OR "elevated platelet count" OR "increased platelet count" OR "essential thrombocytosis") AND ("etiology" OR "causes" OR "risk factors" OR "mechanisms"). La búsqueda quedó limitada a artículos publicados en los últimos 5 años y a artículos en inglés[G3] , dado que es el idioma de predominio en la literatura científica relevante.
B. Bases de datos consultadas
Las principales bases de datos consultadas para la búsqueda fueron PubMed, Scopus y Springer, que están especializadas en el área de investigación de la salud, con las que se desarrolló la revisión sistemática.
C. Criterios de selección
Se realizó un primer tamizado por los revisores, mediante el descarte por la lectura de los títulos. De los artículos no descartados, se realizó la lectura del resumen por 2 revisores, descartando a los que no contaban con los temas de relevancia para la revisión sistemática. A continuación, se realizó un filtrado mediante la lectura completa del artículo por todos los revisores. Se resolvieron los conflictos luego de una conclusión en consenso. Dentro de los criterios de selección en estas últimas fases se tienen:
Criterios de inclusión:
Se incluyeron múltiples tipos de estudios y artículos de revisión, que fueron publicados en buscadores científicos como PubMed, Scopus y Springer. La antigüedad máxima considerada fue de hasta 5 años. Adicionalmente, los artículos debían estar redactados en inglés y ser de acceso libre para su revisión y lectura.
Criterios de inclusión:
Se incluyeron aquellas fuentes que presentaron: (1) Estudios realizados en humanos, (2) estudios que cuenten con exámenes de recuento plaquetario ≥ 350 (×103/μL), (3) estudios con muestra de participantes ≥ 5, (4) estudios que proporcionen datos del evento patológico que cause la trombocitosis.
Criterios de exclusión:
Se excluyeron aquellas fuentes si eran: (1) estudios asociados a fármacos, (2) estudios de reportes de casos y descriptivos, (3) estudios que no relacionen la trombocitosis a una etiología patológica, (4) estudios sin cifras de prevalencia o asociación de trombocitosis; donde no se cumplan los requisitos de los criterios de inclusión, y los que tuvieron conflictos de interés.
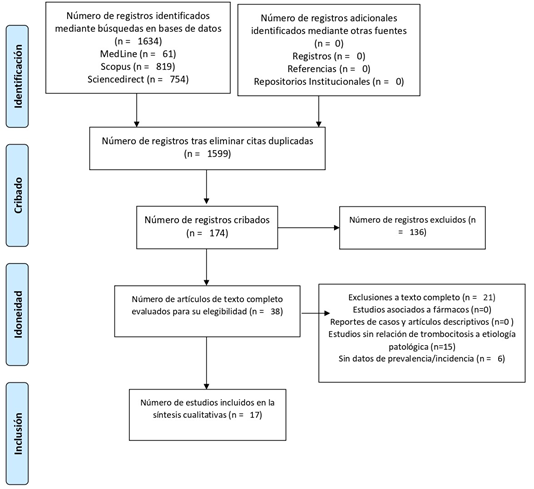
Figura 1. Flujograma PRISMA
Resultados
Tabla 1. Neoplasias asociadas a la manifestación de trombocitosis.
|
Autor- año |
Objetivo |
Diseño/Muestra |
Método |
Resultados |
|
Bailey 2020 (8) |
Establecer si la trombocitosis tiene un valor de estratificación significativo en pacientes atendidos en atención secundaria. |
Revisión retrospectiva que incluye 2236 pacientes con sospecha de cáncer colorrectal (CCR) |
Recuento de células sanguíneas periféricas |
El diagnóstico de CCR fue más probable en pacientes con trombocitosis (12,4% frente a 5,2%, chi-cuadrado 17,70, p =<0,0001) en comparación con aquéllos con recuento normal. |
|
Yuan et al. (2020) (9) |
Determinar el papel preciso de los recuentos de plaquetas previo al tratamiento de cáncer de pulmón |
Metaanálisis de 40 estudios que incluyó 16.696 pacientes con cáncer de pulmón |
Valor de corte para aumento del recuento plaquetario < 300 (p< 0,05), 300-400 y ≥400 (P< 0,001) |
El recuento plaquetario elevado se asoció con mal pronóstico (HR=1,54 [IC95% 1,37-1,72], P <0,001), y permitió diferenciar el estadio I-III (HR = 1.52, IC 95 %: 1,22-1,89, p<0,001) y estadio >III (HR = 1.7, IC 95 %: 1,26-2,29, p<0,001) |
|
Hu, Hada y Han (2020) (10) |
Determinar el impacto de los niveles de plaquetas, DD y fibrinógeno en plasma previo tratamiento en cáncer de ovario epitelial recurrente (COE). |
Cohorte retrospectiva que incluye 104 mujeres COE. |
Plaquetas antes del tratamiento, niveles y parámetros clínico-patológicos, |
Al momento del diagnóstico se presentó trombocitosis y aumentaron en el momento de la recurrencia (p=0.007). |
|
Ha et al (2023) (11) |
Investigar la utilidad de la puntuación de Khorana (SK) actual para la predicción de la trombosis asociada al cáncer en pacientes coreanos con cáncer |
Cohorte retrospectiva de 11714 pacientes con cáncer diagnosticados y con quimioterapia 2015 - 2021. |
Hemograma antes de la quimioterapia obtenido de historia clínica. |
Se encontró una prevalencia de trombocitosis del 19,7% entre los pacientes. La trombocitosis no se asoció con el desarrollo de tromboembolismo venoso a los 6 meses. |
|
Ham et al. (2023) (12) |
Investigar la importancia clínica de la composición corporal en pacientes con cáncer epitelial de ovario, trompas de Falopio y peritoneo. |
Cohorte retrospectiva de 216 pacientes con EOFPC |
Valores plaquetarios obtenidos de historia clínicas |
La trombocitosis fue significativamente más frecuente en los pacientes del grupo de RMFv alta (25,4%) que en los pacientes del grupo de RMFv baja (10,5%) (p < 0,02) |
Tabla 2. Enfermedades infecciosas asociadas a la manifestación de trombocitosis.
|
Autor- año |
Objetivo |
Diseño/Muestra |
Método |
Resultados |
|
Alkan (2022) (13) |
Evaluar parámetros hematológicos en niños con COVID-19 y determinar los efectos de los biomarcadores inflamatorios en la evaluación de la hospitalización. |
Revisión retrospectiva. 633 niños con COVID-19 |
Recuento de células sanguíneas periféricas |
Se encontró trombocitosis en el 8.8% de los pacientes. La trombocitosis fue un indicador significativo (OR 1.004 [IC 95% 1.001-1.007]; p<0.022) para predecir la hospitalización. |
|
Ji et al. (2021) (14) |
Evaluar resultados de laboratorio relacionados con la inflamación en distintos grupos de edad de pacientes pediátricos con COVID-19 |
Observacional retrospectivo. 217 pacientes con COVID-19 en estadío moderado |
Analítica sanguínea al ingreso. Análisis por grupos de edad |
Los pacientes menores de 1 año eran los más vulnerables a tener trombocitosis a comparación del resto de los grupos (p<0,001). |
Tabla 3. Enfermedades hematológicas asociadas a la manifestación de trombocitosis.
|
Autor- año |
Objetivo |
Diseño/Muestra |
Método |
Resultados |
|
Elstrott et al (2022) (15) |
Determinar la relación entre la anemia por deficiencia de hierro (IDA) y la función plaquetaria |
Cohorte retrospectiva que incluyó a 231 mujeres premenopáusicas. |
Recuento de plaquetas en sangre periférica
|
Se detectó trombocitosis en 7.8% antes de la toma de suplemento de hierro, y en 3%, después del suplemento, (p < 0.05). |
|
Wang (2022) (16) |
Usar la trombocitosis preoperatoria para predecir la existencia de infarto esplénico post esplenectomía |
Revisión retrospectiva que incluyó 6 casos de torsión esplénica |
Recuento de plaquetas preoperatorio |
4 pacientes con infarto esplénico tuvieron trombocitosis y los dos con bazo viable tuvieron un recuento normal de plaquetas. |
|
Yang et al. (2021) (22) |
Comparar eventos trombóticos y recuentos de células sanguíneas periféricas entre pacientes con MPL+ y JAK2V617F+ET[G4] |
Metaanálisis de 7 estudios (5 prospectivos y 2 retrospectivos). 3453 pacientes con trombocitemia esencial. |
Recuento de células sanguíneas periféricas |
El recuento de plaquetas es mayor en pacientes con mutación MPL a comparación de mutación JAK2V617F [DMP=81.18 (31.77-130.60), P = 0.001] |
Tabla 4. Enfermedades inmunológicas asociadas a la manifestación de trombocitosis.
|
Autor- año |
Objetivo |
Diseño/Muestra |
Método |
Resultados |
|
Fawzy, A et al (2017) (18) |
Determinar asociación de la trombocitosis y EPOC, incluyendo la EACOPD reportada, los síntomas respiratorios y la capacidad de ejercicio. |
Cohorte observacional multicéntrica. 1820 participantes de SPIROMICS y 2185 de COPDGene |
Recuento de plaquetas en sangre periférica |
Se detectó trombocitosis en el 6,8% (n=124) de los participantes de SPIROMICS y en el 5,1% (n=111) (5.1%) de COPDGgene. Se asoció con EPOC grave ([ORa] 1,5; [IC 95%]: 1.1-2.0). |
|
Fawzy et al (2019) (19) |
Evaluar la relación entre el recuento de plaquetas y la mortalidad en pacientes con EPOC estable, en un análisis secundario del Estudio SUMMIT. |
Fumadores actuales o exfumadores de 40 a 80 años con EPOC moderada y riesgo cardiovascular. |
Recuento de plaquetas en sangre periférica, muestras de sangre venosa antes de la aleatorización y a los 3 meses |
El 9% de los pacientes con trombocitosis murieron por todas las causas, el 6% tuvieron una morbilidad cardiovascular, 38% tuvieron una exacerbación moderada/ grave y el 10% una exacerbación grave de la EPOC. |
|
Deng L y Zheng P. (2023) (20) |
Investigar características clínicas, de laboratorio y radiológicas de pacientes con espondiloartritis (EspA) que presentan trombocitosis |
Observacional retrospectivo y prospectivo con 145 pacientes con EspA, de los cuales 69 tenían trombocitosis |
Recuento de plaquetas en sangre periférica
|
Se encontró trombocitosis en 69 pacientes (47,59%), (239,51 ± 41,08 × 109/uL) |
Tabla 5. Otras enfermedades asociadas a la manifestación de trombocitosis
|
Autor- año |
Objetivo |
Diseño/Muestra |
Método |
Resultados |
|
Duker et al. (2023) (21) |
Evaluar las complicaciones, como la vasculopatía, en pacientes con enanismo primordial osteodisplásico microcefálico tipo II (MOPDII) |
Estudio retrospectivo, revisión de 47 pacientes de edades entre 3 y 41 años con MOPDII. |
Recuento de plaquetas en sangre periférica
|
El 90% (37 de 41) mostraron hallazgos de laboratorio que indicaban trombocitosis, y se registró un recuento de plaquetas máximo de 1803 × 103/uL. |
|
Dressler 2020 (22) |
Evaluar el recuento de plaquetas antes y durante la dieta cetogénica (KD) en la epilepsia infantil. |
Cohorte prospectiva. 162 niños con epilepsia que recibieron KD |
Mediciones seriadas de recuentos de plaquetas |
Se observó trombocitosis leve en el 24% antes del tratamiento con KD, que fue más pronunciada en la epilepsia aún no tratada, pero que se normalizó al recibir la dieta. |
|
Huang et al. (2023) (23) |
Demostrar la asociación entre colonización intestinal de Clostridium perfringens en bebés con alergias alimentarias |
Estudio observacional. 358 bebés de 0 a 6 meses, de los cuales 270 con seguimiento por 12 meses |
Síntomas, muestras de heces para cultivo y análisis de sangre. |
18,18% (42/231) de los pacientes tenían trombocitosis (>400 x 103/uL). 34.82% Clostridium perfringens (39, p<0.001). Hubo correlación positiva entre alergia alimentaria y niveles plaquetarios. |
|
Hovgesen et al. (2022) (24) |
Comparar la función plaquetaria en neonatos prematuros nacimientos y a la edad esperada a término con función plaquetaria |
Artículo de investigación de 43 neonatos prematuros |
Recuento de plaquetas en sangre periférica
|
Los neonatos prematuros tuvieron una mediana de recuento de plaquetas significativamente menor que los recién nacidos a término al nacer. |
En un estudio observacional retrospectivo que incluyó a 2236 pacientes adultos con sospecha de CCR, se detectaron 130 CCR (5.8%) y, de éstos, el 19.2% tuvo trombocitosis. Se identificó a la trombocitosis como un factor de riesgo importante para el diagnóstico de CCR, dado que ésta se asoció significativamente con el diagnóstico de CCR en estadío avanzado y otros cánceres del lado derecho. En algunos casos de CCR en etapa temprana, la trombocitosis fue el único indicador anormal(8).
Como manifestación del cáncer del pulmón, se utilizó el recuento plaquetario para predecir la supervivencia y el avance de la enfermedad. Estos valores plaquetarios se asociaban a la presencia de la enfermedad antes del tratamiento (HR = 1.54, IC del 95 %: 1,37-1,72, p <0,001), e incluso permitió reconocer el estadío del cáncer de pulmón, estadío I-III (HR = 1.52, IC 95 %: 1,22-1,89, p<0,001) y en el estadío >III (HR = 1.7, IC 95 %: 1,26-2,29, p<0,001). Por ello es que el cáncer de pulmón forma parte de la etiología de trombocitosis(9).
Un estudio de cohorte retrospectivo(10) encontró trombocitosis al medir los niveles de plaquetas de 104 mujeres con cáncer de ovario epitelial recurrente, sin antecedentes de otras neoplasias, antes del tratamiento. Se encontró trombocitosis en el 57,7% (n=60) de las pacientes al momento del diagnóstico. Durante la terapia se redujeron los niveles de plaquetas a valores normales en el 86,5% de los casos y aumentaron en el momento de la recurrencia (p= 0,007). En la recurrencia, entre las pacientes que sí respondieron al tratamiento primario, un 56% (51/91) tenía trombocitosis y los casos de trombocitosis se normalizaron en el 92.3% de los casos.
Un estudio unicéntrico de cohorte retrospectiva encontró una prevalencia de trombocitosis (≥ 350 × 103/μL) del 19,7% entre 11714 pacientes con cáncer de diversas etiologías en tratamiento quimioterápico. El estudio mostró que la trombocitosis no se asociaba al desarrollo de tromboembolismo venoso(11).
Un estudio retrospectivo multicéntrico evaluó los índices de músculo esquelético (IMS) y visceral (RMFv) y de la relación grasa-músculo total (RMFt) en 153 pacientes con cáncer epitelial de ovario, trompas de Falopio y peritoneo (EOFPC). Se encontró una mayor prevalencia de trombocitosis (> 400 x 103/μL) en los pacientes con RMFv alta (25,4%, n=17/67) que en los pacientes del grupo de RMFv baja (10,5%, 9/86) (p < 0,02). Además, los RMFv alta eran mayores y con mayor prevalencia de obesidad, DM e HTA y su subtipo de cáncer era predominantemente seroso(12).
Se realizó un estudio en 633 niños con COVID 19, donde se compararon los parámetros hematológicos al ingreso de dos grupos: ambulatorios y hospitalizados. Se encontró que el 8.8% del total de los pacientes tuvo trombocitosis, y que los recuentos diferenciales de plaquetas en ambos grupos sugirieron una diferencia significativa con p < 0.05. La trombocitosis se identificó como uno de los indicadores estadísticamente significativos para predecir la hospitalización (OR 1.004; IC 95% 1.001-1.007; p= 0.022), pues los pacientes hospitalizados del estudio tuvieron recuentos más altos de plaquetas que los pacientes ambulatorios(13).
En un estudio observacional retrospectivo(14) se encontró una prevalencia de trombocitosis del 20,7% (n=45) entre 217 pacientes pediátricos con COVID-19 moderado. Se registró trombocitosis en el 5,6% (n=3) de 11 a 15 años, 10,8% (n=7) de 7 a 10 años, 22,4% (n=13) de 1 a 6 años, y en el 55% (n=22) de menores de 12 meses, siendo el grupo más vulnerable a presentar trombocitosis. No hubo diferencias significativas según sexo.
Un estudio de cohortes multicéntrico evaluó la función plaquetaria en 217 pacientes posmenopáusicas con déficit de hierro. Se encontró una disminución de la prevalencia de trombocitosis (≥ 400 x 103/ul) del 7,8% (n=18 pacientes) al 3% (n=7) luego de administrar hierro por vía endovenosa(15).
En un estudio realizado en seis niños diagnosticados de torsión esplénica, se encontró que cuatro de los pacientes con trombocitosis preoperatoria tenían infarto esplénico, mientras que dos de los pacientes con recuentos de plaquetas preoperatorios normales tenían bazos viables. Además, informaron que el 100% presentó trombocitosis en el quinto día postoperatorio(16).
En estudios observacionales multicéntricos de 1820 participantes de SPIROMICS y 2185 de COPDGene se buscó determinar la asociación de la trombocitosis con la morbilidad por EPOC mediante el recuento de plaquetas en sangre periférica. Se detectó trombocitosis en 124 (6,8%) de los participantes en SPIROMICS y en 111 (5,1%) de los participantes de COPDGene. Además, se asoció el desarrollo de EPOC en pacientes con trombocitosis obtenido que el odds ratio ajustado (ORa), lo que indica que las personas con trombocitosis tienen 1,5 veces más probabilidades de desarrollar EPOC grave que las personas con un recuento normal de plaquetas, con un [IC 95%]: 1,1-2,0(17).
Se realizó un análisis secundario post hoc en una submuestra de 1797 pacientes del estudio SUMMIT, con el objetivo de evaluar la relación entre el recuento de plaquetas y la mortalidad en pacientes con EPOC estable. Se observó una relación compleja entre el recuento de plaquetas y la mortalidad por todas las causas a largo plazo, sin una asociación clara con un nivel específico de recuento de plaquetas(18). Se obtuvo que el 9% de los pacientes con trombocitosis murieron por todas las causas asociadas al EPOC, el 6% tuvo una morbilidad cardiovascular, 38% tuvo una exacerbación moderada/grave de la EPOC y el 10% una exacerbación grave de la EPOC(18).
Se evaluaron características clínicas, de laboratorio y radiológicas, como los factores de riesgo asociados a la trombocitosis en pacientes con espondiloartritis (EspA). La muestra fue de 145 pacientes, de los cuales 69 presentaron trombocitosis y, de ellos, 38 recibieron terapia anti-TNF-α. Los resultados revelaron que los pacientes con EspA y trombocitosis tenían una mayor actividad de la enfermedad, valores más elevados en la velocidad de sedimentación globular, proteína C reactiva y fibrinógeno. Además, la terapia anti-TNF-α demostró ser más efectiva en dichos pacientes(19).
El enanismo primordial osteodisplásico microcefálico tipo II (MOPDII) fue el tema de investigación en donde se buscó evaluar la vasculopatía. Al revisar los registros médicos de 41 individuos entre 3 y 41 años se encontró que el 64% de ellos tenía diagnóstico de moyamoya, aneurismas intracraneales o ambas afecciones. En los exámenes de laboratorio se obtuvo que el 90% presentó trombocitosis con el recuento de plaquetas más alto de 1803 × 103/uL(20).
En niños con dieta cetogénica (KD) como tratamiento no farmacológico de su epilepsia se observó un progreso de trombocitosis de leve a moderada en el 24% de los pacientes antes de la KD, siendo más pronunciada en pacientes que no habían recibido tratamiento anteriormente, la cual se resolvió con la KD(21).
Un metaanálisis de 7 estudios evaluó las mutaciones genéticas en pacientes con trombocitemia esencial (TE), comparando las mutaciones en MPL y JAK2V617F. Recuentos de plaquetas mayores a 400 x 103/uL fueron más frecuentes en mutaciones del gen MPL en comparación con JAK2V617F [DMP=81,18 (31,77-130,60), p = 0,001](22).
Un estudio observacional(23) evaluó bebés de 0 a 6 meses, con síntomas gastrointestinales y cultivos fecales sugerentes de colonización por Clostridium perfringens. Dentro de los cultivos positivos un 34.82% (n=39) tuvo trombocitosis (> 400 x 103/uL). Por otro lado, hubo correlación positiva entre la alergia alimentaria y el aumento de los niveles de plaquetas (p<0,0001); entre los niveles de plaquetas y uso de antibióticos (p<0,0001) y sangre oculta en heces (p<0,0001). También hubo una correlación negativa con los niveles de hemoglobina sérica (p<0,0001).
Se evaluaron 43 neonatos prematuros nacidos en la edad gestacional (EG) 28 + 0 a 34 + 0 y 21 neonatos nacidos a término en EG 38 + 0 a 41 + 0, con el objetivo de comparar la función plaquetaria mediante un examen de plaquetas en sangre periférica. Se obtuvo que los neonatos prematuros tuvieron una mediana de recuento de plaquetas significativamente menor que los recién nacidos a término al nacer. Cuando los recién nacidos prematuros alcanzaron la edad prevista de término, la mediana del recuento de plaquetas fue de 476 × 103/uL (RIQ, 374-560×103/uL), que fue significativamente mayor que en los recién nacidos prematuros y a término al nacer(24).
Discusión
La trombocitosis puede ser de tres tipos: fisiológica, primaria o secundaria (reactivas). Fisiológicamente puede suceder durante el embarazo o ejercicio; las formas primarias se refieren a trastornos mieloproliferativos; y las secundarias son una manifestación de otros procesos como inflamación crónica, cáncer, infecciones, anemia ferropénica, daños tisulares, etc.(25-27). En el caso específico de las neoplasias mielodisplásicas/mieloproliferativas (MDS/MPN), hay subtipos que se pueden clasificar debido a una trombocitosis secundaria. De hecho, la Organización Mundial de la Salud (OMS) actualmente reconoce las neoplasias mielodisplásicas/mieloproliferativas con sideroblastos en anillo y trombocitosis (MDS/MPN-RS-T) como una entidad distinta. Esta condición se caracteriza por mutaciones genéticas, siendo las mutaciones en SF3B1 las más comunes, presentes en el 60-90% de los pacientes, mientras que la mutación JAK2 V617F ocurre en un porcentaje menor(28).
La trombocitemia esencial se caracteriza por la trombocitosis. Sin embargo, las diversas etiologías genéticas pueden resultar en recuentos de plaquetas significativamente diferentes. Algunas de las mutaciones se encuentran en CALR, JAK2 (V617F) o MPL, siendo las dos primeras las más frecuentes. El grado de trombocitosis también se encuentra diferenciado según la mutación presente. La alteración en CALR afecta los receptores de trombopoyetina, causando su activación y las vías de señalización subsiguientes, presenta recuentos plaquetarios mayores comparada a las otras mutaciones, condicionado en el pronóstico y tratamiento de la TE(29, 30). En un estudio comparativo entre JAK2V617F y MPL encuentra que los recuentos plaquetarios son mayores en pacientes con mutaciones en MPL(22).
La trombocitosis se ha asociado al desarrollo de cáncer, particularmente con la enfermedad metastásica en caso de recuentos muy elevados. Incluso forma parte de algunos algoritmos pronósticos, siendo un indicador desfavorable(8,9,31,32). Los cánceres de mayor incidencia asociados a trombocitosis son los de la cavidad abdominal, en especial de páncreas, vesícula biliar y riñón(8,11).
Se sugiere que la base fisiopatológica de esta asociación es la secreción de citocinas por parte de las células tumorales, particularmente IL-6, que estimula la síntesis hepática de trombopoyetina, y factor estimulante de colonias(33). Luego, el aumento de la actividad plaquetaria favorece el desarrollo tumoral al interferir con la actividad inmune. De hecho, se ha demostrado en estudios murinos que el uso de AINEs y coxibs regula los niveles de plaquetas y reduce la progresión tumoral(34,35).
La trombocitosis como condición secundaria a un estado proinflamatorio se ha explorado en otras enfermedades, como la artritis reumatoide, EPOC, epilepsia y procesos infecciosos e inflamatorios en niños, cuyo sistema inmune inmaduro aumenta la susceptibilidad a infecciones y a tener trombocitosis reactiva(21,36,37).
En este sentido, las plaquetas también se han evaluado como marcadores de infección bacteriana, sepsis y de la propia actividad inmune(38-41). No obstante, la relación con el sistema inmune podría ser recíproca, ya que la trombocitosis se relaciona con enfermedades con complicaciones, pero se ha postulado que las plaquetas son componentes importantes de la actividad inmunitaria(18,39). Entonces, su hallazgo podría significar un estado inflamatorio con una respuesta inmune presente. Esto podría explicar por qué la trombocitosis es uno de los principales hallazgos en el curso clínico del COVID en niños, particularmente en el COVID-19 de tipo leve.
Finalmente, otras causas secundarias son: la liberación desde la reserva esplénica, la esplenectomía en pacientes con secuestro esplénico o la asplenia funcional y la trombocitosis reactiva, que es una respuesta normal del organismo a la pérdida de sangre o a la inflamación, En el caso de la anemia ferropénica, se considera que el aumento de las plaquetas es un intento del organismo de compensar la pérdida de glóbulos rojos y la disminución del flujo sanguíneo(15,16). Como también puede ser consecuencia de una regulación fisiológica durante el desarrollo de niños prematuros justificada debido a un aumento de la agregación plaquetaria y de los marcadores de activación plaquetaria en comparación con sus niveles al nacer a término(24).
Limitaciones del estudio e importancia de la investigación
Este estudio se centra en pacientes con condiciones médicas específicas, lo que podría limitar su aplicabilidad a otros contextos. Además, algunos de los resultados se basan en hallazgos de otros estudios revisados, lo que puede introducir posibles sesgos o limitaciones inherentes a estudios previos.
La importancia de esta investigación radica en su contribución a la comprensión de las diversas causas de trombocitosis, lo que puede ser relevante para una mejor comprensión de los mecanismos subyacentes, un diagnóstico más integral y abrir nuevas vías de investigación en el campo de la medicina.
Conclusión
Los estudios analizados revelan una asociación significativa entre la trombocitosis y diversas patologías. La trombocitosis se ha identificado como un indicador estadísticamente significativo en el diagnóstico y pronóstico de estas condiciones, lo que subraya la importancia de su monitoreo en la práctica clínica. Además, se destaca la diversidad de factores y condiciones subyacentes que pueden contribuir a la trombocitosis, incluyendo mutaciones genéticas, procesos inflamatorios, y tratamientos médicos. Debido a eso se necesita una mayor investigación para comprender completamente las implicancias clínicas de la trombocitosis en cada contexto específico y su impacto en la salud pública.
Bibliografía
1. Baumeister J, Chatain N, Sofias AM, Lammers T, Koschmieder S. Progression of Myeloproliferative Neoplasms (MPN): Diagnostic and Therapeutic Perspectives. Cells. 2021;10(12):3551.
2. Wiedmeier SE, Henry E, Sola-Visner MC, Christensen RD. Platelet reference ranges for neonates, defined using data from over 47 000 patients in a multihospital healthcare system. Journal of Perinatology. 2009;29(2):130-6.
3. Ashorobi D, Gohari P. Essential Thrombocytosis. 2023 Aug 6. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-.
4. Karagianni A, Ravid K. Myeloproliferative disorders and their effects on bone homeostasis: the role of megakaryocytes. Blood. 2022;139(21):3127-37.
5. Rokkam VR, Killeen RB, Kotagiri R. Secondary Thrombocytosis. 2023.
6. Babacan A, Şenol FF. Thrombocytosis in children. Rev Assoc Med Bras. 2023;69(6).
7. Tefferi A, Barbui T. Polycythemia vera and essential thrombocythemia: 2021 update on diagnosis, risk‐stratification and management. Am J Hematol. 2020;95(12):1599-613.
8. Bailey JA, Hanbali N, Premji K, Bunce J, Mashlab S, Simpson JA et al. Thrombocytosis helps to stratify risk of colorectal cancer in patients referred on a 2-week-wait pathway. Int J Colorectal Dis. 2020;35(7):1347-50.
9. Yuan Y, Zhong H, Ye L, Li Q, Fang S, Gu W et al. Prognostic value of pretreatment platelet counts in lung cancer: a systematic review and meta-analysis. BMC Pulm Med. 2020;20(1):96.
10. Hu Q, Hada A, Han L. Platelet count as a biomarker for monitoring treatment response and disease recurrence in recurrent epithelial ovarian cancer. J Ovarian Res. 2020 Jul 18;13(1):78.
11. Ha H, Ko YH, Kim K, Hong J, Lee GW, Jeong SH et al. Application of the Khorana score for cancer-associated thrombosis prediction in patients of East Asian ethnicity undergoing ambulatory chemotherapy. Thromb J. 2023;21(1):63.
12. Ham S, Choi JH, Shin SG, Lee EJ. High visceral fat-to-muscle ratio is an independent factor that predicts worse overall survival in patients with primary epithelial ovarian, fallopian tube, and peritoneal cancer. J Ovarian Res. 2023;16(1):19.
13. Alkan G, Sert A, Emiroglu M, Tuter Oz SK, Vatansev H. Evaluation of hematological parameters and inflammatory markers in children with COVID-19. Irish Journal of Medical Science (1971 -). 2022;191(4):1725-33.
14. Ji SQ, Zhang M, Zhang Y, Xia K, Chen Y et al. Characteristics of immune and inflammatory responses among different age groups of pediatric patients with COVID-19 in China. World J Pediatr. 2021 Aug;17(4):375-384.
15. Elstrott BK, Lakshmanan HHS, Melrose AR, Jordan KR, Martens KL, Yang C et al. Platelet reactivity and platelet count in women with iron deficiency treated with intravenous iron. Res Pract Thromb Haemost. 2022;6(2):e12692.
16. Wang Z, Peng C, Wu D, Wang K, Chen Y. Diagnosis and treatment of splenic torsion in children: preoperative thrombocytosis predicts splenic infarction. BMC Pediatr. 2022;22(1):440.
17. Yang E, Wang M, Wang Z, Li Y, Wang X, Ming J et al. Comparison of the effects between MPL and JAK2V617F on thrombosis and peripheral blood cell counts in patients with essential thrombocythemia: a meta-analysis. Ann Hematol. 2021;100(11):2699-706.
18. Fawzy A, Putcha N, Paulin LM, Aaron CP, Labaki WW, Han MK et al. Association of thrombocytosis with COPD morbidity: the SPIROMICS and COPDGene cohorts. Respir Res. 2018;19(1):20.
19. Fawzy A, Anderson JA, Cowans NJ, Crim C, Wise R, Yates JC et al. Association of platelet count with all-cause mortality and risk of cardiovascular and respiratory morbidity in stable COPD. Respir Res. 2019;20(1):86.
20. Deng L, Zheng P. Thrombocytosis in patients with spondyloarthritis: a case-control study. BMC Musculoskelet Disord. 2023;24(1):195.
21. Duker AL, Kinderman D, Jordan C, Niiler T, Baker-Smith CM, Thompson L et al. Microcephalic osteodysplastic primordial dwarfism type II is associated with global vascular disease. Orphanet J Rare Dis. 2021;16(1):231.
22. Dressler A, Chiara H, Benninger F, Waldhoer T, Gröppel G, Trimmel-Schwahofer P et al. Effects of the ketogenic diet on platelet counts and global coagulation tests in childhood epilepsy. Seizure. 2020;80:31-7.
23. Huang KY, Liang BS, Zhang XY, Chen H, Ma N et al. Molecular characterization of Clostridium perfringens isolates from a tertiary children's hospital in Guangzhou, China, establishing an association between bacterial colonization and food allergies in infants. Gut Pathog. 2023 Oct 8;15(1):47.
24. Hovgesen NT, Hviid CVB, Grevsen AK, Hansen AK, Hvas A. Reduced platelet function in preterm neonates compared with term neonates. Res Pract Thromb Haemost. 2022;6(5):e12751.
25. Penman ID, Ralston S, Strachan MWJ, Hobson RP. Haematology and transfusion medicine . En: Davidson’s principles and practice of medicine [Internet]. 24a ed. 2022 [citado 30 de octubre de 2023]. p. 921-88. Disponible en: https://www.clinicalkey.es/#!/content/book/3-s2.0-B9780702083471000259?scrollTo=%23hl0005583
26. Wijeysundera DN, Finlayson E. Evaluación preoperatoria. En: Miller Anestesia [Internet]. 9a ed. 2021 [citado 30 de octubre de 2023]. p. 918-98. Disponible en: https://www.clinicalkey.es/#!/content/book/3-s2.0-B9788491137368000314?scrollTo=%23hl0004521
27. Prieto JM, Ramón J. Hematología clínica. En: Balcells La clínica y el laboratorio [Internet]. 23a ed. 2019 [citado 30 de octubre de 2023]. p. 3-38. Disponible en: https://www.clinicalkey.es/#!/content/book/3-s2.0-B9788491133018000011?scrollTo=%23hl0000786
28. Mangaonkar AA, Lasho TL, Ketterling RP, Reichard KK, Gangat N et al. Myelodysplastic/myeloproliferative neoplasms with ring sideroblasts and thrombocytosis (MDS/MPN-RS-T): Mayo-Moffitt collaborative study of 158 patients. Blood Cancer J. 2022 Feb 1;12(2):26.
29. Wu Z, Zhang C, Ma X, Guan M. Clinical relevance between CALR mutation and myeloproliferative neoplasms. Stem Cell Investig. 2015 Feb 16;2:4..
30. Guglielmelli P, Calabresi L. The MPL mutation. Int Rev Cell Mol Biol. 2021;365:163-178..
31. Liu P, Hsu C, Su C, Huang Y, Hou M, Rich NE et al. Thrombocytosis is associated with worse survival in patients with hepatocellular carcinoma. Liver International. 2020;40(10):2522-34.
32. Kuter DJ. Treatment of chemotherapy-induced thrombocytopenia in patients with non-hematologic malignancies. Haematologica. 2022;107(6):1243-63.
33. Suzuki-Inoue K. Platelets and cancer-associated thrombosis: focusing on the platelet activation receptor CLEC-2 and podoplanin. Blood. 2019;134(22):1912-8.
34. Hufnagel DH, Cozzi GD, Crispens MA, Beeghly-Fadiel A. Platelets, Thrombocytosis, and Ovarian Cancer Prognosis: Surveying the Landscape of the Literature. Int J Mol Sci. 2020;21(21):8169.
35. Menter DG, Tucker SC, Kopetz S, Sood AK, Crissman JD, Honn KV. Platelets and cancer: a casual or causal relationship: revisited. Cancer Metastasis Rev. 2014 Mar;33(1):231-69.
36. Stockklausner C, Duffert CM, Cario H, Knöfler R, Streif W, Kulozik AE. Thrombocytosis in children and adolescents—classification, diagnostic approach, and clinical management. Ann Hematol. 2021;100(7):1647-65.
37. Kucine N, Chastain KM, Mahler MB, Bussel JB. Primary thrombocytosis in children. Haematologica. 2014;99(4):620-8.
38. D'Angelo G. Microbiota and Hematological Diseases. Int J Hematol Oncol Stem Cell Res. 2022 Jul 1;16(3):164-173.
39. Maouia A, Rebetz J, Kapur R, Semple JW. The Immune Nature of Platelets Revisited. Transfus Med Rev. 2020 Oct;34(4):209-220.
40. Buchrits S, Gafter-Gvili A, Bishara J, Atamna A, Ayada G, Eynath Y, Avni T. The Importance of Abnormal Platelet Count in Patients with Clostridioides difficile Infection. J Clin Med. 2021 Jun 30;10(13):2957.
41. Lagrange J, Lacolley P, Wahl D, Peyrin-Biroulet L, Regnault V. Shedding Light on Hemostasis in Patients With Inflammatory Bowel Diseases. Clin Gastroenterol Hepatol. 2021 Jun;19(6):1088-1097.e6.